산화 공정 정리 글
2022.10.12 - [전자공학/2. Oxide] - 2. 산화 공정) 반도체 산화 공정 (feat. Gate Oxide)
2. 산화 공정) 반도체 산화 공정 (feat. Gate Oxide)
왜 '실리콘'이 반도체에 사용이 되며, '신의 물질'이라고 하는지 아시나요? 실리콘의 장점은 크게 3가지입니다. 1. 모래의 주 성분으로 지구에 엄청 많습니다. 집 앞 놀이터에도 모래가 엄청 많죠.
yonsekoon.tistory.com
이 글은 위 글을 추가 설명하기 위해서 작성된 글입니다.
열 산화 공정의 Mechanism
산화 공정의 Mechanism에 대해서 자세히 살펴보겠습니다.
이 Mechanism을 통째로 'Deal-Groove Mechanism'이라고 합니다.
Mechanism은 크게 3가지 단계로 구분 지어 설명을 합니다.

1. 산화 종의 공급
산화 종을 chamber 내에서 공급하는 단계를 말합니다.
Henry의 법칙을 따릅니다.
2. 산화 종의 확산
Si와 SiO2의 계면까지 산화 종이 이동을 하는 단계를 말합니다.
픽의 확산 식은 다음과 같습니다.
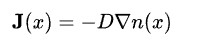
D : 확산 계수, n(x) : 농도
확산 계수와 온도 관계입니다.

확산 계수와 온도는 exp 하게 증가합니다.
3. 산화 종의 반응
Si와 SiO2의 계면에서 산화 종이 Si과 반응하는 단계를 말합니다.
반응 식은 다음과 같습니다.
J = KN
K : 반응속도 상수
반응속도 상수와 온도 관계입니다.
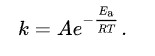
반응속도 상수와 온도는 exp 하게 증가합니다.
더 구체적인 식은 아래 위키백과를 참고해 주세요.
https://en.wikipedia.org/wiki/Deal%E2%80%93Grove_model
Deal–Grove model - Wikipedia
From Wikipedia, the free encyclopedia Jump to navigation Jump to search Mathematical model of semiconductor oxidation The Deal–Grove model mathematically describes the growth of an oxide layer on the surface of a material. In particular, it is used to pr
en.wikipedia.org
확산/반응의 속도의 느린 부분이 전체 속도를 결정합니다.
초기 반응
초기 상태는 반응의 속도가 느려 반응 속도가 전체 속도를 결정합니다.
초기 상태는 산화막이 거의 없는 상태이기 때문에 산화 종이 공급되는 순간 반응이 시작됩니다.
어느 정도 산화막이 증착이 될 때까지 반응 속도가 확산 속도에 비해 느립니다.
산화물과 두께의 관계는 다음과 같습니다. (앞선 식들로 유도를 한 결과입니다.)
x(t) = B/A * (t + τ)이며, B/A는 linear rate constant로 Nok/n의 값과 같게 됩니다.
온도 의존성 변수는 오로지 k(반응 속도 상수)가 됩니다.
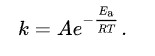
결론적으로, 두께는 시간과 비례한다는 점을 알 수 있으며 온도와도 비례한다는 점을 알 수 있습니다.
* 결정방향마다 표면의 원자 개수가 다르기 때문에, 원자의 개수가 많을수록 반응이 빨라집니다.
후기 반응
후기 상태는 확산의 속도가 느려 확산 속도가 전체 속도를 결정합니다.
산화막이 매우 많이 증착되어 있어 산화 종이 확산되기 어렵기 때문입니다.
산화물과 두께의 관계는 다음과 같습니다.
x(t) = 루트(B(t+τ))이며, B는 parabolic rate constant로 2DNo/n 값과 같게 됩니다.
온도 의존성 변수는 오로지 D(확산 계수)가 됩니다.

결론적으로, 두께는 시간과 log 관계로 비례한다는 점을 알 수 있으며 온도와도 비례한다는 점을 알 수 있습니다.
* 확산이 중요하므로 결정 방향이 의미는 없어지게 되고, 확산이 보다 잘 되는 H2O 가스의 반응이 O2보다 훨씬 빨라지게 됩니다.

따라서, 초기에는 Reaction에 의존하다가 시간이 지날수록 Diffusion에 의존하게 됩니다.
시간이 증가할수록 SiO2의 두께 증가량은 감소하게 되죠.
Oxidation rate 변수
Oxidation rate 변수는 크게 6가지로 나뉩니다.
1. 결정 방향
결정 방향은 앞서 말씀드린 대로, 반응이 전체 속도에 관여하는 초기에만 변수로 작용합니다.
(111)이 (100)보다 표면적에 보이는 원자의 개수가 많아 반응이 더 빠릅니다.
2. 산소 압력
산소의 압력이 증가할수록 oxidation rate이 빨라집니다.
3. 온도
온도가 증가할수록, oxidation rate이 exp 하게 커집니다.
온도가 너무 증가하면, thermal budget 현상으로 인해 소자 불량을 야기합니다.
Thermal budget 현상의 대표적인 예는 다음과 같습니다.
- 원하는 확산 종뿐 아니라 다른 원자들도 확산되기 쉬워집니다.
- 금속이 녹을 수도 있습니다.
- 열팽창 계수 차이로 인해 stress가 생겨 defect가 유발됩니다.
따라서, oxidation rate을 증가시키기 위해 산소 압력과 온도를 적당히 조절하는 공정 최적화를 진행합니다.
온도가 30도 증가 = 압력이 1 atm 증가
이런 효과를 통해 thermal budget을 최소화시킵니다.
4. 습식, 건식
습식 산화가 건식 산화보다 빠릅니다.
H2O의 원자가 상대적으로 가볍고, 질량이 작기 때문에 빠르게 됩니다.
5. 도핑
도핑을 하면 산화 속도가 더 빨라집니다.
3가 원자의 도핑 같은 경우 편석 계수가 작아 SiO2에 머무르는 것을 좋아해 확산속도가 커집니다. (후기부터 빨라지겠죠.)
5가 원자의 도핑 같은 경우 편석 계수가 커 Si에 머무르는 것을 좋아해 Si와 SiO2의 계면에서 머무르게 됩니다. 따라서 반응속도가 커집니다.(전기에 빨라지겠죠.)
6. 가스 환경
Cl, F 등 할로겐 원소를 집어넣을 시, oxidation rate가 빨라지게 됩니다.
'반도체 8대 공정 > 2. Oxide' 카테고리의 다른 글
| 2.4 산화 공정) CMOS에서 사용되는 산화막, 유전체 (USG, PSG, BPSG), 증착 방식 (1) | 2022.12.03 |
|---|---|
| 2-2 산화 공정) 유전율, high k, low k에 대해서 알아보자 (0) | 2022.11.15 |
| 2-1 산화 공정) 반도체 산업에서 산화막은 단결정일까 비정질일까? (0) | 2022.11.14 |
| 2. 산화 공정) 반도체 산화 공정 (feat. 습식 산화가 빠른 이유) (2) | 2022.10.12 |





댓글